El número de Avogadro es una cantidad la búsqueda de cuyo valor surge a partir de la formulación de la hipótesis de Avogadro en 1811. A pesar del avance que hubiera supuesto la aceptación de la hipótesis de Avogadro por parte de la comunidad científica, ésta pasó desapercibida durante casi 50 años. Fue gracias a la insistencia de un joven científico italiano llamado Cannizzaro que tal hipótesis fue aceptada e incorporada por la comunidad científica durante el congreso internacional de Química de Karlsruhe del año 1860 lo que supuso un punto de inflexión para el surgimiento de la Química moderna. Desde entonces, numerosos y diversos fueron los experimentos realizados para arrojar este dato cuyo valor se estima en la actualidad igual a 6,023 x 10 ^ 23 desde el año 1908. Esta es la cantidad de unidades elementales (átomos, moléculas, iones, fotones, ...) que se estima está contenida en un mol de sustancia.
Bienvenido a PRACTICA CIENCIA. Este es un blog dedicado a la divulgación científica. Su principal característica es un enfoque basado en la experimentación como punto de partida y en presentar cada nueva entrada justo cuando las anteriores han fijado de manera sólida los conocimientos previos necesarios. Este blog hace uso sistemático de vídeos de youtube, ya que el autor considera que no hay nada como ver para creer y hoy en día hay excelente material didáctico en la red el cual puede ser legalmente utilizado ya que apuntamos directamente a la fuente y al autor del mismo. Así, este blog está cogiendo el formato de lo que podríamos denominar una "youtupedia": entradas apoyadas por vídeos donde hay multitud de enlaces que nos derivan a otras entradas y en el que además se intenta que haya siempre un hilo conductor. Todo ello amenizado por los propios comentarios del autor que son fruto de su experiencia en el campo, tras años de estudio y autoindagación.
miércoles, 27 de agosto de 2014
sábado, 23 de agosto de 2014
CONCEPTO DE MOL
La hipótesis de Avogadro establecía una relación entre los volúmenes de los reactivos iniciales y los productos finales de una reacción química a través del número de moléculas contenidos en ellos bajo condiciones fijas de presión y temperatura. Pero no daba ninguna estimación sobre el número concreto de moléculas contenidas en los mismos.
El concepto de mol surge como unidad para poder expresar la medida de la cantidad de sustancia (átomos o moléculas) contenida en un volumen dado. La definición parece más sencilla si se apoya en átomos de Hidrógeno, ya que en ese caso un mol de átomos de Hidrógeno es la cantidad de sustancia contenida en un gramo del mismo. Pero por razones técnicas e históricas se ha impuesto la utilización del Carbono-12 para su definición.
A día de hoy se define un mol como la cantidad de átomos contenidos en 12 gramos de Carbono-12. El concepto de mol puede aplicarse entonces tanto a átomos, moléculas, iones, electrones.
El número concreto de átomos o moléculas o cualquier otro elemento contenidos en un mol de sustancia viene dado por el famoso número de Avogadro, cuyo valor sin embargo tardó décadas en poderse medir de forma experimental tras el postulado de la hipótesis de Avogadro.
La Química de principios del Siglo XIX era un hervidero de hallazgos pero en caos en su formulación, en la que surgían muchos conceptos nuevos y nuevas leyes pero, al no haber unas convenciones que marcaran unos patrones de referencia común, costaba mucho sacar en claro las conexiones de unos descubrimientos con otros. Se considera que el Congreso de Química de Karlsruhe de 1860 supuso un punto de inflexión en el que de verdad se sentaron esas bases en las que se establecía una nomenclatura y acordaban unas definiciones comunes para los conceptos básicos más importantes, como el de mol.
viernes, 15 de agosto de 2014
HIPÓTESIS DE AVOGADRO: 2 + 1 = 2.
El científico italiano Amedeo Avogadro tuvo una gran aportación en el mundo de la Química aunque fuera poco reconocida en su época. Durante la segunda mitad del siglo XVIII y principios de siglo XIX la Química estaba en plena ebullición, entrando en su edad de oro. Cada dos por tres se identificaban nuevos elementos químicos. Un montón de reacciones químicas eran estudiadas, disponiéndose de aparatos de medidas para poder registras las condiciones de presión, volumen, peso y temperatura tanto de los productos iniciales como de los resultantes.
Cuando tanto los reactivos iniciales como los productos finales obtenidos se presentaban en estado gaseoso, se constataba en la gran mayoría de los casos el cumplimiento de ciertas proporciones entre los volúmenes ocupados por los gases antes y después de la reacción. Pero en algunos casos curiosos la relación no resultaba obvia ni mucho menos intuitiva.
Por ejemplo, se observaba que si se mezclaban dos volúmenes iguales de hidrógeno con un volumen igual de oxígeno se obtenían dos volúmenes de vapor de agua (cuando la intuición nos dice que 2 + 1 volúmenes deberían ser iguales a 3 volúmenes).
Avogadro consiguió encontrar la explicación a tal aparente contradicción, lo que puede resumirse en una Ley y una aclaración.
- Ley de Avogadro: Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas.
- Distinción entre átomos y moléculas: el matiz importante aportado por el propio Avogadro fue el de definir las moléculas de un gas como agregados atómicos que se componen siempre de átomos concebidos como entidades indivisibles. La consecuencia de ello es que las moléculas deben tener siempre como mínimo dos átomos.
Entonces, cuando estamos combinando dos volúmenes de hidrógeno con uno de oxígeno debemos pensar que tanto uno como el otro se encuentran en su estado molecular, que es di-atómico. Por lo tanto, tenemos un volumen 2V con moléculas de H2 y un volumen V con moléculas O2.
Avogadro establece una proporcionalidad entre el número total de moléculas de gas en un volumen dado (para condiciones de presión y temperatura fijas). Así que habrá un total de 2n moléculas de hidrógeno por n moléculas de oxígeno. Lo que ocurre en la reacción es que cada molécula de oxígeno se disocia, de forma que cada átomo de oxígeno se combina con una molécula de hidrógeno (H2) para formar vapor de agua (H2O). ¿Cuántas moléculas de agua habrá al final? 2n.
Y por lo tanto el volumen final de vapor de agua será 2V, tal como se observaba.
Por lo tanto, en Química, se puede cumplir que 2V + V = 2V.
miércoles, 13 de agosto de 2014
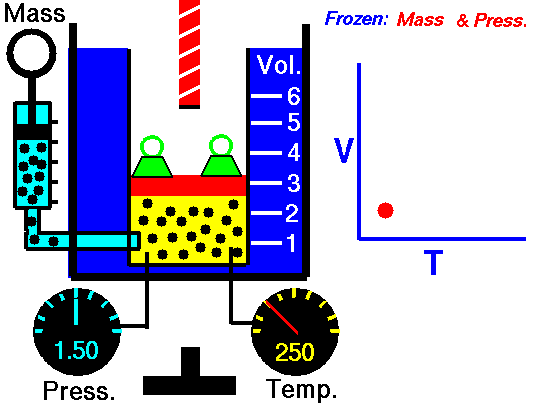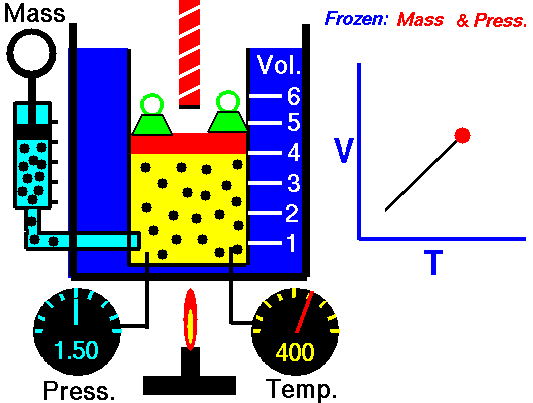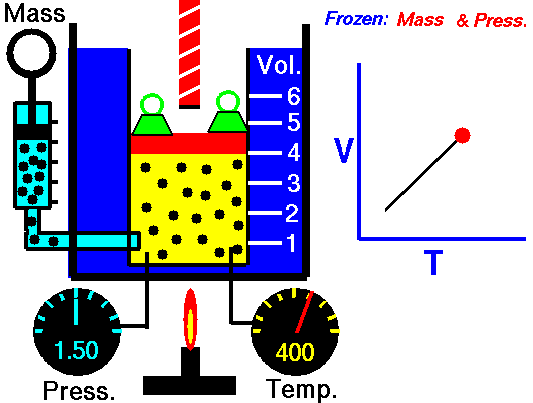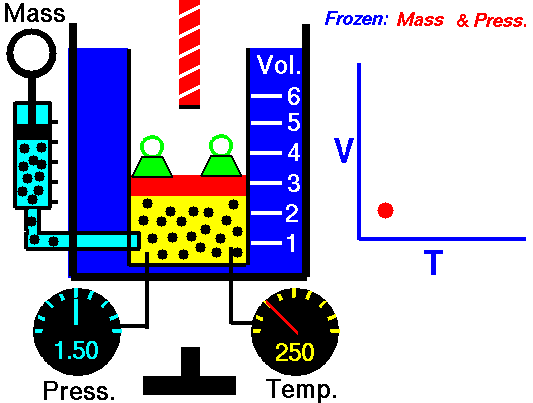
LEY DE CHARLES
La Ley de Charles establece la proporcionalidad entre la temperatura y el volumen en aquellos procesos que se producen a presión constante. Aunque fue establecida por Charles en 1797 no fue sino publicada hasta el año 1802 por Gay-Lussac, por lo que se conoce indistintamente con Ley de Charles y de Gay-Lussac.
martes, 12 de agosto de 2014
LEY/ES DE GAY-LUSSAC
Para el estudio de las primeras máquinas de vapor era importante conocer la Ley de los Gases Ideales, ya que en esencia lo que se comprime y expande realizando un trabajo mecánico en una máquina de vapor es un gas ideal.
La Ley de los Gases Ideales es básicamente la síntesis de otras leyes: la ley de Boyle-Mariotte y las leyes de Gay-Lussac.
La Ley de Boyle fue enunciada a mediados del siglo XVII y establece la proporcionalidad inversa entre presión y volumen en un gas ideal a temperatura constante. Surge del interés de Boyle por experimentar con la presión siguiendo la estela de las grandes demostraciones que realizó Otto von Gericke para realizar el vacío en la conocidas como esferas de Magdeburgo. La ley obtuvo finalmente el nombre de Ley de Boyle-Mariotte por las aportaciones que hizo este último de forma paralela y en investigaciones independientes.
P·V = k1
P1/V1 = P2/V2
La primera Ley de Gay-Lussac no es sino el enunciado oficial de la Ley de Charles en la que se establece la proporcionalidad entre volumen y temperatura a presión constante. En otras palabras, Charles ya había descubierto esta ley en 1797 pero no la publicó. Sino que fue Gay-Lussac quien la publicó por primera vez en 1802, aunque eso sí, haciendo mención de los estudios de Charles. Por esto esta ley se conoce indistintamente como Ley de Charles y de Gay-Lussac. De todas maneras, hay referencias de que el primero en dejar constancia escrita de estudios sobre la proporcionalidad del volumen y la temperatura fue un físico e inventor francés llamado Amontons en el año 1702.
V = k2 · T
V1/T1 = V2/T2
La Ley de Charles y Gay-Lussac es la que se puede ver reproducida en el vídeo de youtube que acompaña esta entrada.
La segunda Ley de Gay-Lussac sí que se considera enteramente introducida por sí mismo y establece la proporcionalidad entre la presión y la temperatura a volumen constante. Vamos, lo que le ocurre a una olla exprés, donde el volumen del recipiente cerrado es constante, y vemos que al calentarla aumenta la presión. Lo que hizo Gay-Lussac fue enunciar que esa relación entre P y T es directamente proporcional.
P = k2 · T
P1/T1 = P2/T2
Aunque realmente la relación lineal entre P y T no pasa por el origen y por su corte con el eje de la presión evidencia la existencia de un cero absoluta de temperaturas que extrapolando resulta ser de -273.15 ºC.
Suscribirse a:
Comentarios (Atom)