Podemos definir la energía interna de un sistema cerrado como la suma de todas las energías que podemos atribuir a sus elementos constituyentes. Éstas pueden ser básicamente de dos tipos:
- la energía cinética (de traslación, de rotación y de vibración) de cada una de las partículas constituyentes.
- la energía potencial debida a la interacción de cada partícula con todas las demás. Téngase en cuenta aquí que en este caso, cada interacción puede resultar en una contribución positiva o negativa ya que, si nos centramos por ejemplo en la interacción eléctrica (la más común), las cargas que interactuan pueden tener el mismo signo o contrario.
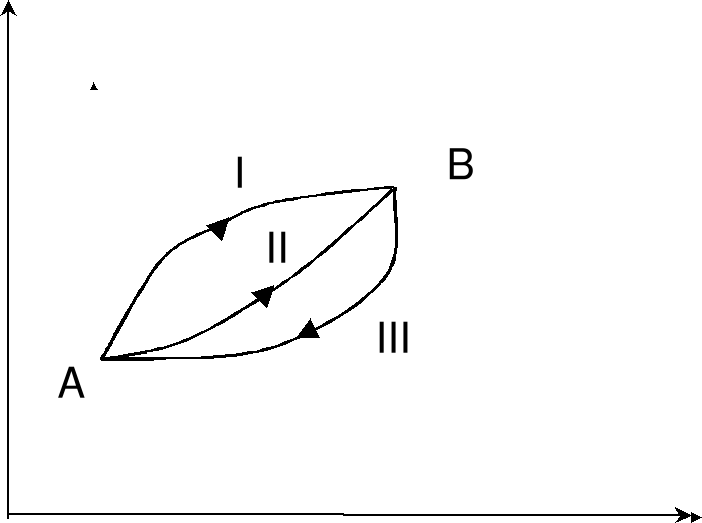
La energía interna solamente depende del estado del sistema: es una función de estado. Por lo tanto, un cambio en la energía interna sólo depende del cambio en las variables de estado (en A y en B) y no del camino recorrido para realizar ese cambio (I, II o III).
Además, la energía interna es una variable extensiva, ya que aumenta o disminuye con la cantidad de sustancia (lógicamente si hay más partículas la energía en su conjunto será mayor).


No hay comentarios:
Publicar un comentario